羅伯特·惠特克-2020 年 1 月 19 日
12月23日,FDA批准了一種治療精神分裂症的新藥lumateperone,據稱是“一流”的藥物,表明其作用機制不同於目前使用的抗精神病藥物。JAMA Psychiatry上的一篇文章總結說,這種新藥“顯示出改善精神分裂症症狀的功效和良好的安全性”。
在 FDA 給予批准後,將 Lumateperone 推向市場的公司Intra-Cellular Therapies的股價在 12 月 23 日飆升,從 12.44 美元上漲至 36.51 美元。該公司的估值當天上漲了 13 億美元,讓投資者有理由舉起一杯香檳。
在公司的新聞稿中,美國精神病學協會前主席杰弗裡·利伯曼(Jeffrey Lieberman)是試驗的首席研究員,同時也是細胞內療法的顧問,他講述了lumateperone是如何成為精神分裂症藥箱中受歡迎的補充.
“精神分裂症是一種嚴重影響患者及其家人的複雜疾病。及時有效的治療可以改變精神分裂症患者的遊戲規則,”他說。“ FDA 批准的 Caplyta 的療效和安全性為醫療保健提供者提供了治療精神分裂症患者的重要新選擇。”
這是向公眾講述的一般故事,1 月 10 日在線發表的JAMA Psychiatry文章為 FDA 的決定提供了科學批准印章。這是一種新型藥物,已被證明是一種安全有效的精神分裂症治療方法。JAMA Psychiatry的一篇社論總結了它所代表的可能的治療進展。
“雖然我們不知道 lumateperone 的最終比較優勢是什麼,但看到一種具有新藥理特性的新藥通過藥物開發和美國食品和藥物管理局的批准取得進展是令人鼓舞的,並且可能令人興奮。”
科學的偽裝
雖然這是公開的故事,但深入研究 lumateperone 的“證據”表明,這種藥物的臨床試驗和批准最好被描述為一種偽裝,一種科學偽裝的遊戲。在他們的設計中,臨床試驗是對慢性患者突然停止服用精神科藥物後使用的藥物的研究,而不是對“精神分裂症藥物”的研究。即使在這種情況下,該藥物在三項研究中的任何一項中都不是可靠的最佳安慰劑。
“新型”藥物聲明也不是完全準確的。
考慮到精神分裂症新藥測試的歷史以及對該過程的商業影響,lumateperone 試驗的設計沒有什麼特別新的,甚至是令人驚訝的。lumateperone 的臨床試驗並沒有以任何顯著的方式偏離標準。然而,這種藥物的批准確實提供了一個機會,讓我們重新看到,從科學的角度來看,精神分裂症的抗精神病藥物測試是一個致命的缺陷過程,產生的“發現”幾乎不能說明藥物作為“治療精神分裂症”的功效。”
事實上,lumateperone 試驗中最有趣的發現引發了一個令人驚訝的問題:為什麼在 28 天的研究期間,慢性患者突然退出所有精神科藥物並隨機分配到安慰劑組?這一結果與人們在突然戒斷精神藥物後所經歷的情緒和身體困難的所有已知情況背道而馳。突然停止服藥的患者預計會變得更糟,至少在停藥後的短時間內會變得更糟,但在這種情況下情況並非如此。
像氯氮平這樣的藥物
Lumateperone 正在被推廣為一種不會引起現有抗精神病藥物副作用的新型化合物。Lumateperone,JAMA 精神病學文章的作者寫道,“是一種機制上新穎的精神分裂症研究藥物。作用機制是獨特的,因為它同時調節血清素、多巴胺和谷氨酸神經傳遞,這些是與嚴重精神疾病有關的關鍵神經傳遞。. . 此外,lumateperone 缺乏與可能導致其他抗精神病藥物副作用的脫靶受體的相互作用。”
換句話說,這種新分子有點像靈丹妙藥。它“調節”據說是導致精神分裂症的神經遞質,但是——如果JAMA 精神病學報告可信的話——它不會與其他神經遞質相互作用,從而導致其他抗精神病藥物所產生的副作用。
這讓人想起 1990 年代 Risperdal 和 Zyprexa 上市時的“突破性”聲明。然而,正如用於獲得 FDA 批准的 Intra-Cellular 的 III 期研究方案所表明的那樣,lumateperone 在對多巴胺和血清素的影響方面與氯氮平非常相似。
所有抗精神病藥都會阻斷 D 2受體,這被認為是減少幻覺和其他精神病症狀的機制。在治療劑量下,大多數抗精神病藥阻斷超過 60% 的紋狀體 D 2受體。然而,正如協議所述,Intra-Cellular 的藥物也是如此。在其 II 期試驗中測試的 120 mg 劑量阻斷了 70% 的紋狀體 D 2受體,而 60 mg 劑量阻斷了 50%。
儘管 60 mg 劑量的阻滯作用略低於大多數抗精神病藥物,但與氯氮平的 D 2阻滯作用相似。氯氮平和其他“第二代”抗精神病藥也能阻斷血清素能 (5HT 2a ) 受體,而氯氮平(在這方面最有效的藥物)能阻斷 90% 的這些受體。
在 60 mg 劑量下,這正是 lumateperone 的作用。該協議指出,Lumateperone“類似於氯氮平,當紋狀體 D 2受體佔用率相對較低時,皮質 5HT 2a受體完全飽和。”
研究人員已經確定了藥物對特定神經遞質的阻斷所產生的特徵性副作用。阻斷多巴胺和血清素途徑雖然被認為具有治療益處,但會引起許多副作用。氯氮平類藥物可能不會像阻斷較高百分比的 D 2受體的藥物那樣經常引起錐體外系症狀,但它可能具有鎮靜作用並引起代謝變化,從而導致體重顯著增加。
雖然JAMA Psychiatry的社論吹捧 lumateperone 具有“新的藥理特性”,但它也承認其主要作用機制,即阻斷多巴胺和血清素,是現有抗精神病藥物的作用。“它的作用機制是否真正新穎仍然沒有答案,”社論說。“lumateperone 仍然有可能只是另一種‘我也是’的第二代抗精神病藥。”
字謎的元素
協議
Lumateperone 在一項 II 期研究和兩項 III 期研究中進行了測試,每項研究持續 28 天,設計相似。JAMA Psychiatry中的文章報告了研究 301 的結果,並附有協議 pdf 的鏈接。
在研究 301 中,參與者被要求在前三個月一直處於“穩定的生活環境”中,並且在該社區環境中,精神分裂症症狀“惡化”。他們需要有對抗精神病藥物做出積極反應的既往史。最值得注意的是,研究人員需要確定他們可以“安全地停止使用當前的抗精神病藥物、情緒穩定劑、鋰、抗膽鹼能藥物和抗抑鬱藥物”。
排除標準有一長串。研究志願者不能有自殺傾向,不能濫用藥物(酒精或其他藥物),也不能有“臨床上異常的實驗室值”。他們也不可能患有任何嚴重的“血液、腎臟、肝臟、內分泌、神經系統或(或)心血管疾病”,他們也不可能有“抗精神病藥物惡性綜合徵病史”。
為這項研究招募的人被送入住院病房,並在第一天突然停止服用所有精神科藥物。如果臨床研究人員決定滴定停藥是合適的,則最多可以在四天內完成。在隨機分組之前,每個人都必須至少停藥三天。
在可能持續長達 7 天的篩選期結束時,如果患者在陽性和陰性症狀量表(PANSS) 上得分為 70 或更高,他們將被隨機分配到研究中。該納入標準將選擇至少“輕度至中度疾病”的患者。
在研究 301 中,患者被隨機分配到 60 mg 或 40 mg 劑量的 lumateperone 或安慰劑組。在為期 28 天的研究中,研究人員被允許開勞拉西泮,用於“激動、焦慮或幫助睡眠”。
療效的主要衡量標準是 PANSS 評分從基線到第 28 天研究結束的變化。研究人員在他們的JAMA文章中報告說,該研究的設計有能力證明“效應大小為 0.4”,這相當於藥物和安慰劑在減輕症狀方面的六分差異。
研究人群
可以看出,納入排除標準旨在招募一組選定的“精神分裂症”患者。參加者來自社區中穩定的環境,以前對抗精神病藥物反應積極,沒有濫用酒精或其他藥物,並且健康狀況相對較好,即使他們可能已經接觸抗精神病藥物多年。與隨機招募的“精神分裂症”患者相比,這些標準被用於選擇對抗精神病藥物產生反應的可能性更高的患者,並且鑑於他們相對健康的狀況,遭受不良反應的風險較低。
製藥公司經常使用包含排除標準從診斷組中選擇最有可能對藥物反應良好的患者子集。然而,眾所周知,由於這種選擇過程,結果可能無法反映藥物在“現實世界”患者群體中的有效性。
這個“現實世界”問題最引人注目的例子來自抗抑鬱藥試驗。二十年前,NIMH 資助了兩項針對“現實世界”患者的抗抑鬱藥 研究,在這兩項研究中,其中一項是大型 STAR*D 研究,反應和緩解率非常差,明顯低於商業上的反應率資助的藥物試驗。
這是 lumateperone 試驗中的第一個偽裝元素,這是大多數由行業資助的精神科藥物試驗的常見元素。該試驗使用包含排除標準來招募一部分患者,與“真實世界”的一組患者相比,這些患者的反應率更高,不良事件更少。研究志願者不代表“真實世界患者”的橫截面,但結果被宣傳為證明“真實世界”使用的有效性和安全性。
之前的藥物暴露
在研究 301中,隨機分配到研究中的 449 名患者平均年齡為 42 歲,並且他們在 17 年前被診斷出來。至少 94% 的人在研究前服用過精神科藥物,近三分之二的人服用勞拉西泮。患者服用的最常見的抗精神病藥是喹硫平、利培酮、氟哌啶醇、奧氮平和阿立哌唑。所有患者均有抗精神病藥物暴露史。
眾所周知,抗精神病藥和其他精神科藥物會改變大腦。它們擾亂神經遞質系統,作為回應,大腦會經歷一系列補償性適應,以維持“穩態平衡”。在這個過程結束時,前 NIMH 主任斯蒂芬海曼在 1996 年的一篇論文中寫道,大腦的運作方式“在質量和數量上都不同於正常狀態”。
例如,抗精神病藥阻斷 D 2受體。作為回應,大腦會增加其 D2 受體的密度。因此,任何長時間接觸抗精神病藥的人都會有這種異常高密度的 D 2受體,而這只是多年接觸抗精神病藥和其他精神藥物所引起的眾多變化之一。
由於這種藥物暴露,lumateperone 沒有在“精神分裂症患者”中進行測試,就好像他們的大腦現在處於最初的“疾病”狀態。這種藥物正在對那些由於多年接觸抗精神病藥和其他精神藥物而大腦發生顯著重塑的人進行測試,如果這項研究中的患者有任何共同的生理機能,那就是異常——例如 D 2受體的增加——由接觸藥物引起。
每個人都知道這一點。然而,房間裡的這頭科學大像從未被討論過。相反,假裝是藥物清洗設計消除了這種先前藥物使用的影響,並使研究參與者恢復到原始的“精神分裂症”生理狀態。這允許聲稱一種藥物已經過“疾病”測試,儘管實際上它是在一群大腦因多年接觸藥物而“異常”的患者身上進行測試的。
應該指出的是,這種偽裝貫穿了 65 年的臨床 RCT 評估抗精神病藥物的短期療效。正如 Lieberman 及其同事在2017 年的一篇論文中承認的那樣,從未有過針對未用藥患者的抗精神病藥物的“隨機、雙盲、安慰劑對照研究”。換句話說,沒有良好的科學記錄表明這些藥物對那些大腦沒有因先前接觸過抗精神病藥物而改變的精神病患者有效,即使在短期內也是如此。
無安慰劑對照
眾所周知,被診斷患有某種疾病的人可能會在不接受治療的情況下好轉,對於被診斷患有精神病的人來說尤其如此。安慰劑對照旨在提供對這種自然恢復能力的測量,並理解為了使藥物治療有效,該藥物必須提供比安慰劑組中的“自然恢復”更好的結果。
在這項研究中,突然戒斷設計產生了一個患有戒斷症狀的“安慰劑組”,而不是“未服藥的”精神分裂症,並且有很長的研究記錄記錄了與突然戒斷抗精神病藥和其他精神科藥物相關的危害. 這些危害包括精神病症狀、焦慮、恐懼、抑鬱、內心激動、情緒波動、頭痛、失眠、嘔吐和錐體外系症狀可能惡化。
事實上,普遍的想法是,突然將慢性病患者從他們所有的精神科藥物中撤出將是臨床瀆職,因為眾所周知這會使患者處於惡化的巨大風險中。
這裡的偽裝是顯而易見的。一個戒毒組作為安慰劑對照的替代品,它提供了一個“比較”,可以預期使藥物看起來更好。
這個有說服力的事實也經常對醫學文獻的讀者隱藏。在JAMA Psychiatry的文章中,沒有提到參與者在隨機分組之前突然停止服用他們的精神科藥物的事實;論文的“方法”和“討論”部分都沒有說明細節。
藥物恢復研究
鑑於在篩選期間突然停用所有藥物,lumateperone 的試驗被恰當地描述為“藥物恢復”研究。那些被隨機分配到 lumateperone 的人被重新使用相同類型的藥物——一種阻斷多巴胺受體的藥物——他們的大腦已經習慣了這種藥物。
在臨床環境中,這當然是通常的做法。如果精神分裂症患者突然停止服用他或她的藥物並且現在患有精神病症狀,那麼患者很快就會重新服用抗精神病藥物。人們會期望,這種藥物恢復將有助於緩解最初突然停藥後突然出現的症狀。
拋開預期不談,重點是lumateperone 試驗,與大多數採用藥物戒斷設計的行業資助試驗一樣,僅提供對這種藥物在特定臨床情況下可能優點的評估:如果慢性精神分裂症患者突然停止所有藥物,將它們放回lumateperone的短期效果是什麼?在接下來的 28 天裡,他們的表現是否比那些沒有重新服用抗精神病藥物的人更好?
缺失的數據
在 lumateperone 試驗中研究的臨床過程是這樣的:居住在社區的精神分裂症患者在服用藥物時會出現一定程度的惡化。然後他們突然退出所有藥物治療並隨機分配到lumateperone或安慰劑組。在接下來的四個星期裡,他們將留在這個治療組中。
為了對該課程提供清晰的評估,該研究應為參與者提供三個 PANSS 評估:
- 初篩分數
- 突然停藥後的評分(隨機分組前)
- 28 天學習期結束時的分數
在 lumateperone 試驗中,最初篩選時未使用 PANSS。相反,使用快速評估“全球”臨床狀態的量表 (CGI-S) 篩選潛在的新兵,而那些得分至少為 4 分的人被認為可能有資格進入審判。然而,即使是這些在停藥前評估的初始 CGI-S 評分,也從未報告過。
因此,沒有信息詳細說明患者在突然停藥之前的症狀。然而,預計突然停藥會 加劇患者的症狀,至少在很小程度上。這種戒斷引起的惡化然後成為在 28 天結束時評估療效的基線測量值。
通過這種設計,研究參與者最終可能會被評估為對研究藥物有“反應”,即使他或她的情況比第一次篩選試驗時更糟。
例如,在 lumateperone 301 研究中,患者的平均基線 PANSS 評分為 89。但在突然退出之前,他們的 PANSS 評分會是多少?他們可能只是病得很輕,這會產生 60 多歲或 70 多歲的 PANSS 分數,突然退出然後將他們的分數推高到“基線”的 89 分。28 天后,他們的 PANSS 分數可能已降至 70 多歲,現在他們將被歸類為對藥物有反應,儘管他們現在比最初篩選時更差。
如果進行這些研究以提供臨床相關信息,則應在所有三個時刻使用 PANSS 量表評估患者的症狀:初始篩查、突然停藥後和研究結束。然後就有可能評估藥物的“改善”是否是藥物清洗設計的產物。此外,可以看到突然的停藥設計對研究志願者造成了多大的傷害。
同時使用苯二氮卓類藥物
在 lumateperone 試驗中,大約三分之二的患者在停用精神藥物並隨機進入研究之前一直服用勞拉西泮。然而,在隨機化之後,該方案允許研究人員再次開出勞拉西泮來治療焦慮、激動和失眠。在安慰劑組和藥物組中,超過 70% 的患者服用了這種苯二氮卓類藥物。
使用第二種精神藥物顯然會混淆可歸因於研究藥物的功效。作為一名臨床試驗設計專家在涉及百憂解的民事案件中作證,在百憂解研究中同時使用苯二氮卓類藥物“在科學上是不利的”,因為它會“混淆結果”並“干擾對安全性和有效性的分析” 。”
再次,每個人都知道這一點。在 lumateperone 試驗中開具苯二氮卓類藥物有助於隱藏不良反應,並有助於減少 PANSS 評估的 30 種症狀中的許多症狀。雖然當人們突然從所有精神藥物中撤出並出現戒斷症狀時,使用苯二氮卓類藥物肯定具有臨床用途,但假裝來自於忽視使用苯二氮卓類藥物會混淆研究結果。
這種偽裝延伸到發表在JAMA Psychiatry上的文章。沒有提到勞拉西泮的同時使用。必須閱讀協議和在線補充才能找到答案。
突然退出的倫理
醫生和患者都清楚地知道,突然停用抗精神病藥和其他精神科藥物可能是危險的。它使患者面臨任何數量的身體和情感風險,並且在常規臨床護理中,從不建議這樣做。
然而,在 lumateperone 研究中,如果研究人員確定他們可以“安全地”退出所有精神藥物,則可以招募患者。
這種“安全”的措辭旨在為研究提供道德掩護。但是這應該怎麼做呢?該方案沒有為研究人員提供任何方法來確定篩選患者中的哪些人可以“安全地”退出藥物治療。也沒有解釋為什麼可能有一部分慢性患者實際上可以“安全地”一次“安全地”退出所有精神科藥物。
事實上,如果有一部分慢性病患者可以安全地停藥,那麼為什麼“突然停藥”不被視為常規臨床實踐中的一種選擇呢?
這是遊戲中的另一個元素。納入標準為不道德行為提供道德掩護。
底線
研究 301 或其他兩項 lumateperone 臨床研究的設計沒有什麼特別不尋常的地方。但是,從科學的角度來看,這些研究並不能說是對這種藥物對“精神分裂症”的安全性和有效性的檢驗。對這些試驗最好的評價是:在一組被診斷患有精神分裂症的慢性患者中,多年來一直使用抗精神病藥物和其他精神藥物,魯馬替隆在突然停藥後是否會帶來益處?
遊戲是假裝試驗測試了除此之外的東西。
Lumateperone的功效
FDA 通過快速通道批准該藥物的一個顯著方面是,即使在這樣的科學背景下,作為對從所有精神藥物中退出的患者的治療,它也不能可靠地提供益處。
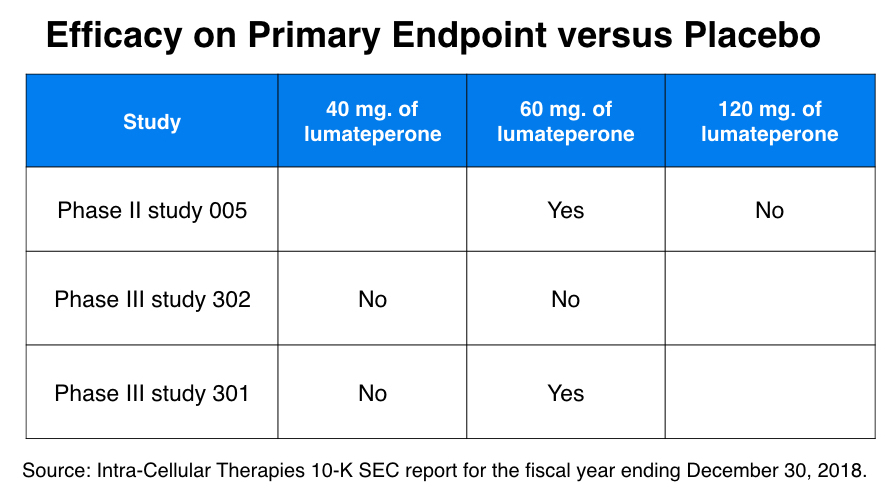
作為其向 FDA 申請的一部分,細胞內療法進行了一項 II 期研究和兩項 III 期研究。它在向美國證券交易委員會 提交的 2019 年 10-K 文件中提供了這些研究的摘要。
在 II 期試驗(研究 005)中,335 名患者被隨機分配到四種治療中的一種:120 mg lumateperone、60 mg lumateperone、4 mg 利培酮或安慰劑。主要終點是從基線到第 28 天研究結束時 PANSS 量表上的症狀減輕。雖然 60 mg 劑量的魯馬泰隆和 4 毫克劑量的利培酮都提供了“統計學上顯著”的益處,但 120 毫克劑量的魯馬泰隆確實不是。*
在兩項 III 期研究(研究 302)中的一項中,患者被隨機分配至 60 mg 劑量的 lumateperone、40 mg 劑量的 lumateperone、利培酮或安慰劑,主要終點是 PANSS 量表上的症狀減輕。在這個終點上,兩種 lumateperone 劑量都沒有“與安慰劑分開”,而利培酮則做到了。
在另一項 III 期研究中,研究 301 中,60 mg 劑量確實在 PANSS 量表上顯示出優於安慰劑的“統計學顯著”益處,但 40 mg 劑量沒有。
因此,在這三項研究中,對 lumateperone 劑量和安慰劑進行了六次比較,在六次中的四次中,與安慰劑相比,該藥物沒有提供益處。60 毫克。劑量是 FDA 批准的劑量,在與利培酮的兩次比較中,它在 II 期研究中提供了相似的結果,但在 III 期研究中不如利培酮。
此外,在研究 301 中,60 mg 劑量對安慰劑的療效是最小的。研究參與者的基線 PANSS 評分為 89-90,在 28 天結束時,60 mg 組的 PANSS 評分平均降低 15.6,而安慰劑組為 12.4。
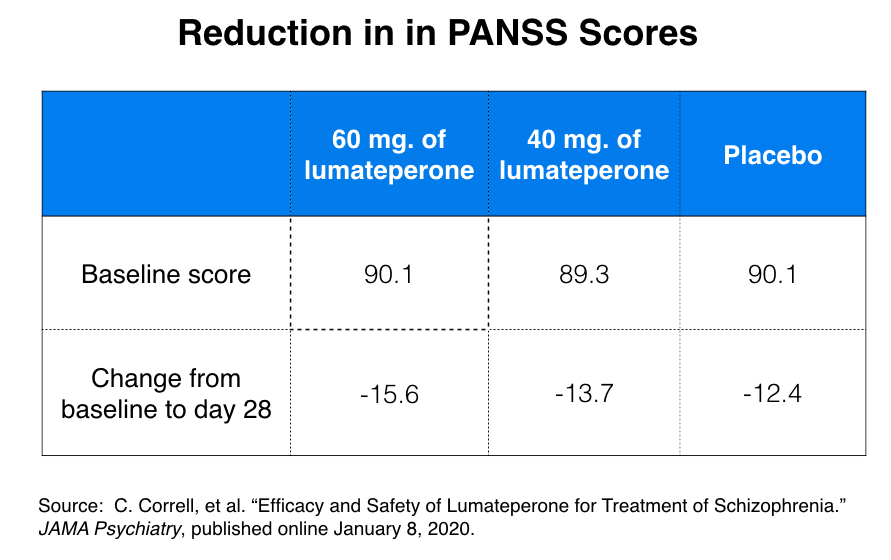
雖然這三點差異具有“統計學意義”,但在臨床上毫無意義。PANSS 以 1 到 7 的等級評估 30 種症狀,這意味著分數的範圍可以從 30 到 210。在2012 年的一篇論文中,研究人員確定 PANSS 量表上需要有 15 分的差異才能使這種差異具有臨床意義。210 分制的三分差異在臨床上並不明顯。
該研究的 301 名研究人員在他們的JAMA Psychiatry文章中也報告了反應率,指出 PANSS 分數降低 20% 將證明患者在研究結束時“略有改善”。60 mg 組中 50% 的患者對這一措施有反應,而安慰劑組為 38%。
這產生了 8 的 NNT,這意味著必須用藥物治療 8 人才能產生額外的“最小改善”反應。這也意味著接受藥物治療的 8 人中有 7 人將遭受藥物的副作用而沒有任何益處。這七人由對藥物無反應者和那些未經治療就會有反應的人(安慰劑反應者)組成。
因此,總而言之:
- 在 PANSS 量表中,只有兩次嘗試證明 lumateperone 在減少症狀的主要終點上“在統計學上優於安慰劑”。
- 在積極的 301 研究中,“有效”劑量 60 毫克的優勢是如此微不足道,以至於在臨床上毫無意義。
- 根據 8 的“最小改善”NNT,接受 lumateperone 治療的 8 人中有 7 人將遭受不良事件的風險而沒有任何益處,因為他們要么對藥物無反應,要么會在沒有任何益處的情況下得到相同程度的改善它。
Lumateperone 的安全性
細胞內療法在推廣 Caplyta 時,吹捧它比目前使用的抗精神病藥更安全,副作用更少。Medscape Psychiatry報告說,臨床試驗中最常見的不良反應是“嗜睡/鎮靜”和“口乾”。
JAMA Psychiatry文章在其結論中提供了關於其副作用概況的類似樂觀圖景。“發生的 lumateperone 組的不良事件是鎮靜、嗜睡、疲勞和便秘,這些都主要是輕微的。”
這似乎說明了一個巨大的進步。沒有代謝功能障礙,沒有顯著的體重增加,也沒有明顯的錐體外系症狀。
以下是此安全配置文件的創建方式。
常見副作用列表
根據 301 研究方案,唯一會記錄的“不良事件”是在 28 天治療期間新出現的那些。試驗參與者可能因前幾年的精神藥物使用而受到不良影響,例如錐體外系症狀,這種症狀在 28 天內一直存在,但除非這些症狀在隨機化後新出現,否則不會報告。在JAMA 精神病學報告中,這些被描述為“治療出現的不良症狀”(TEAS)。
其次,該方案旨在最大限度地減少對此類不良事件的認識。沒有使用要求調查人員詢問潛在負面影響的不良事件清單。相反,該協議規定:“不良事件可能是研究對象自發提出的,也可能是研究人員在體檢期間發現的,或者是通過詢問一個開放的、非主導性的問題,例如‘自上次被問到後感覺如何?’”
這是製藥公司經常使用的一種方法,以盡量減少不良反應的報告。如果你不積極尋找這樣的負面影響,你就不會發現那麼多。
這種方法產生了以下常見副作用列表,這些副作用似乎相當良性。
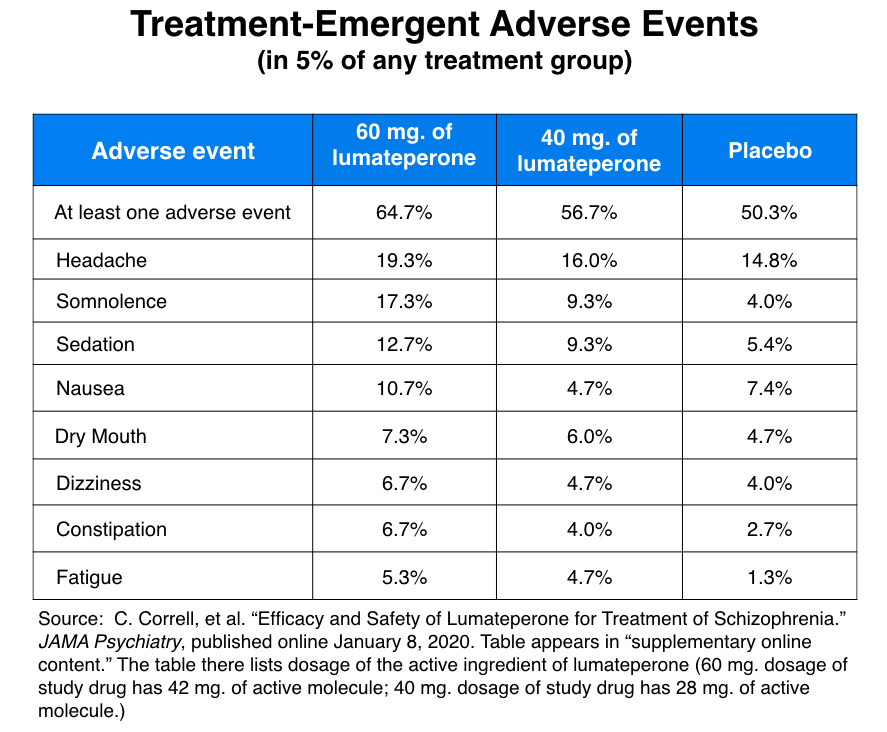
這份清單中明顯缺少的是任何 EPS 症狀的證據,在他們的JAMA報告中,301 名研究人員強調了這一點。“在任何治療組中,5% 或更多的患者都沒有發生與 EPS 相關的 TEAS,”他們寫道。“EPS 相關的 TEAS 很少見。”
錐體外系症狀
第一代抗精神病藥——氯丙嗪、氟哌啶醇等——因引起錐體外系症狀 (EPS) 而臭名昭著。患者出現抽搐、肌張力障礙、帕金森症狀、稱為靜坐不能的內心激動等。第二代抗精神病藥,如奧氮平和喹硫平,在很大程度上被視為改進藥物,因為它們沒有像第一代藥物那樣阻斷D 2受體,因此引起錐體外系症狀的程度較小。
一種根本不會引起 EPS 症狀,但在提高 PANSS 評分方面與現有藥物同樣有效的藥物將被視為顯著改善。儘管不良事件列表似乎表明 lumateperone 不會導致 EPS,但希望提出此聲明的公司需要表明它積極評估了 EPS 症狀,而不是只是等待這些症狀是否顯示為不良事件。
細胞內療法在其試驗中做到了這一點。參加研究 301 的患者接受了基線測試,以評估 EPS 症狀和靜坐不能的存在和嚴重程度,然後在試驗期間和最後一個研究日定期進行這些相同的評估。研究人員報告說,基於這些測量結果,“使用(任一劑量)lumateperone 治療與 EPS 增加無關。”
那個句子中很容易漏掉的關鍵詞增加了。
在JAMA Psychiatry文章中,研究人員報告了從基線到第 28 天 EPS 症狀的平均變化,而不是可能患有此類症狀的患者百分比。在基線時表現出錐體外系症狀的患者在第 28 天仍可能表現出此類症狀,但只要他們的症狀沒有惡化,這不會對他們的 EPS 評分產生任何“平均變化”。
此外,研究人員省略了一些信息,這些信息提供了一些關於在研究期間實際上患有 EPS 的患者百分比的信息。
該方案允許在試驗期間開勞拉西泮來治療激動、焦慮和失眠。所有這些都是與 EPS 相關的症狀,躁動和焦慮被視為藥物引起的靜坐不能的主要體徵(在突然停藥後通常會出現峰值)。調查人員在他們的文章中沒有提到這一事實。但在線補充劑確實如此:超過 70% 的患者在研究期間因焦慮、激動和失眠而服用了勞拉西泮。
然而,一般副作用列表中缺少這些不良事件。
鑑於這種安全性數據的呈現,不可能知道研究 301 中患有 EPS 的患者的百分比。似乎只有少數情況下新出現了此類症狀,總體而言,在這 28 天內,患者組的 EPS 症狀沒有“平均變化”。然而,超過 70% 的患者服用勞拉西泮來治療躁動、焦慮和失眠,這些症狀是靜坐不能的徵兆。看起來 70% 左右的人正在遭受這種“不良事件”的影響。
該公司在其新聞稿中表示,“Caplyta 的錐體外系症狀發生率為 6.7%,安慰劑為 6.3%”,這表明其藥物不會引起此類不良反應。但該公司的新聞稿和JAMA Psychiatry文章中沒有關於勞拉西泮在研究中使用的信息,因此公眾對這種藥物可能導致“焦慮、焦慮和失眠”一無所知。
代謝功能障礙
隨著第二代抗精神病藥的出現,代謝功能障礙——體重增加、糖尿病等——成為最成問題的副作用。該研究 301 名調查人員報告了這種擔憂,其方式與他們報告 EPS 症狀的方式相同。
該方案要求研究人員在基線時評估代謝因素,然後在研究期間和第 28 天再次評估。但在JAMA文章中,研究人員僅報告了從基線到第 28 天的“平均變化”,因此如果患者有異常讀數關於基線的代謝因素,只要與代謝相關的測量結果在四個星期內沒有惡化,lumateperone 似乎不會引起這些問題。
正如研究人員在他們的JAMA文章中所寫,“與安慰劑相比,從基線到第 28 天的代謝參數沒有顯著的平均變化。”
然而,正如研究 301 中經常使用勞拉西泮表明患者繼續患有與靜坐不能有關的症狀一樣,增刊中公佈的體重增加數據表明,lumateperone 與氯氮平一樣,可能會導致代謝問題,至少對於一些患者。60 毫克組的 143 名患者中有 12 名在 28 天內增加了超過基線體重的 7%,這表明他們在短時間內增加了 10 至 15 磅(或更多)。
底線
與現有的精神科藥物相比,lumateperone 可能具有相對良性的安全性。然而,清楚的是,該公司及其研究人員在收集和報告不良事件數據時,並未提供研究期間試驗參與者存在代謝功能障礙和 EPS 症狀的圖片。在這些領域沒有“平均變化”的事實表明,至少那些接受 lumateperone 治療的人在服藥 28 天期間在這兩個領域沒有惡化。但這並不能證明lumateperone不會對現實世界中相當大比例的患者造成這種負面影響。
FDA 批准 Lumateperone
在公司完成 III 期試驗後,FDA 於 2017 年 11 月授予 lumateperone 其“快速通道”稱號。該公司在新聞稿中表示,這是被授予的,因為“lumateperone 有可能解決精神分裂症治療未滿足的醫療需求,並顯著改善幾個臨床上重要的安全參數,包括與代謝、運動和心血管問題相關的問題。與許多目前可用的抗精神病藥物。”
公司提交新藥申請後,FDA 安排了 2019 年 7 月 31 日的諮詢委員會會議。但它取消了 7 月 23 日的會議,這嚇壞了投資界。也許 FDA 沒有發現 lumateperone 的數據非常有說服力。
這些恐懼很快就被平息了。9 月 10 日,FDA 宣布不再計劃舉行諮詢委員會審查,三個月後的 12 月 23 日,它批准了該藥物。儘管缺乏兩項積極的 III 期試驗,但它還是這樣做了,這是獲得藥物批准的通常標準。
2019 年初,FDA 批准 eskatamine 作為抑鬱症的治療藥物,儘管療效證據同樣不具說服力,金融分析師 Paul Matteis 在批准 lumateperone 後解釋了現在明顯的模式。他寫道,“對於神經科學藥物,FDA 比平均水平更靈活”,現在正在採取“半杯半滿的方法”來批准此類藥物。
lumateperone 的開發確實為相關人員帶來了經濟利益。進行試驗的研究人員當然獲得了這項工作的報酬,如上所述,在 FDA 宣布其決定後,Intra-Cellular 的估值在一天內飆升了 13 億美元。從那天起, Intera-Cellular 的首席執行官和首席財務官都出售了他們的股票,每人從這些交易中獲得了超過 100 萬美元的收益。
分析師表示,當該藥在春季推出時,預計該公司將 Caplyta 定價為每月 900 美元。這是沃爾瑪或其他以折扣價銷售仿製抗精神病藥的藥店的仿製藥利培酮 每月成本的 200 多倍。在這個商業領域,費用將由購買藥丸的人承擔。
未回答的問題
如前所述,lumateperone 試驗的一個結果值得進一步研究。為什麼在接下來的 28 天內突然停藥然後隨機分配到安慰劑組的慢性病患者的 PANSS 評分有所改善?復發研究經常告訴戒斷患者,他們的精神病症狀在第一個月會增加,一般的理解是突然戒斷通常會導致許多困難症狀的爆發。但在這種情況下並非如此,並且在行業資助的試驗中經常看到安慰劑組的這種改善,儘管他們的藥物戒斷設計。
該試驗中安慰劑組的改善可能是支持定期使用逐漸減少方案的證據。如果慢性患者在突然停止所有精神科藥物後可以改善,如果他們的精神科藥物逐漸停止,他們在更長的時間內會經歷什麼改善?然而,另一種可能的解釋是,在一項由行業資助的研究中,評估人員預計參與者會有所改善,這種偏見會延伸到接受藥物治療的患者和安慰劑患者。
但這不是藥物試驗的商業資助者或顯然是lumateperone試驗的研究人員感興趣的問題。在他們的JAMA Psychiatr y 報告中,他們甚至沒有提到藥物戒斷設計。沒有討論安慰劑組的這種改善,這代表了這些試驗無助於以任何有意義的方式告知臨床護理的另一種方式。
*******
* 在試驗中測試的分子是 lumateperone tosylate。60 mg 劑量含有 42 mg lumateperone,而 40 mg 劑量含有 28 mg lumateperone。在JAMA Psychiatry文章中,一些研究結果使用 42 mg 和 28 mg 數字呈現。
MIA 報告部分得到開放社會基金會的資助
